电导率 (Conductivity),符号为 κ,是评估材料导电能力的核心物理量。在电解质溶液的语境下,它被定义为电流密度 j 与电场强度 E 的比值,反映了溶液在单位电场强度下传导电流的效率。
κE = j
当我们将两个平行的电极浸入电解质溶液并施加电压时,一个微观的定向运动就开始了。如图1所示,带正电的阳离子向阴极恒速迁移,而带负电的阴离子则向阳极迁移,这种离子的宏观定向流动构成了溶液中的电流。
对于一个截面积为 A、电极间距为 l 的样品,在恒定的电场强度 E 作用下,电极间的电压 U 可以表示为:
U = lE
这个电场会对电荷量为 ze 的离子施加一个静电力 F(其中 z 为离子的电荷数,e 为元电荷)。这个力是驱动离子运动的根本原因。
F = zeE = zeU / l
电场力 F 驱动阳离子和阴离子分别向阴极和阳极加速。然而,离子在溶剂中穿行并非一帆风顺,它会受到与运动方向相反的粘滞阻力 FR,这个阻力的大小与其运动速度成正比。
假设离子的运动遵循斯托克斯定律 (Stoke’s law),那么粘滞阻力可以表示为:
FR = 6πηrwi
这里,r 是离子的水合半径(在水溶液中,离子通常被一层溶剂分子包裹,形成溶剂化层),η 是溶剂的粘度,wi 则是离子的运动速率。
驱动力与阻力方向相反,经过极短时间的加速后,两个力达到平衡(F = -FR),离子将进入一个稳态,以恒定的速率运动。此时,离子的稳态运动速率 wi 为:
wi = E * (|zi|e / 6πη)
从这个关系式中,我们可以提炼出一个不依赖于电场强度的、表征离子本征运动能力的物理量——离子迁移率 (Ion Mobility),用 ui 表示:
ui = |zi|e / 6πη
因此,离子的运动速率可以简洁地表达为电场强度与离子迁移率的乘积,这清晰地揭示了内外因对离子运动的共同影响:
wi = Eui
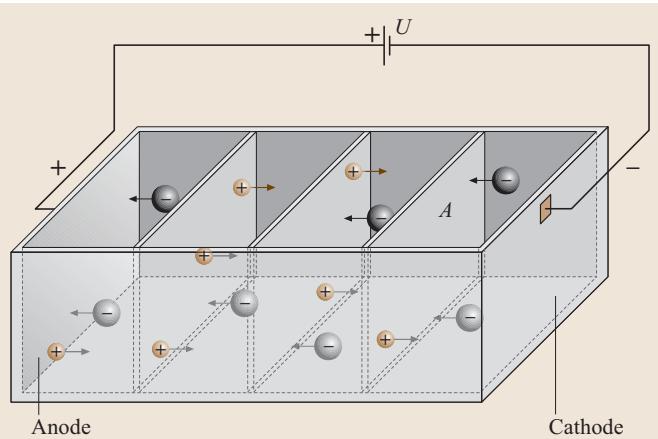 图1. 在Δt时间内,通过截面积A的电荷量分别构成了电流 I+ 和 I-
图1. 在Δt时间内,通过截面积A的电荷量分别构成了电流 I+ 和 I-
我们以浓度为 c 的强电解质氯化钾 (KCl) 为例。它在溶液中解离为 n+ 个阳离子和 n- 个阴离子,其电荷分别为 z+e 和 z-e。单位体积内阳离子和阴离子的数量分别为 n+cNa 和 n-cNa(Na 为阿伏伽德罗常数)。在外加电场作用下,这些离子以 w+ 和 w- 的速率相向运动。如图1所示,在 Δt 时间内,穿过截面 A 的阳离子和阴离子数量分别为 Nacn+|w+|AΔt 和 Nacn-|w-|AΔt。
这些迁移的电荷构成了阳离子电流 I+ 和阴离子电流 I-。引入法拉第常数 F (F = Nae),并结合 w = uE 和 U = lE,我们可以推导出电流的表达式:
I+ = F(U/l)Acn+u+z+ I- = F(U/l)Acn-u-z-
再结合欧姆定律 (I = U/R) 以及电导率 (κ) 与电阻率 (ρ) 的关系 (κ = 1/ρ = l/AR),我们可以将宏观的电导率与微观的离子行为联系起来。
直接测量的电导率 κ 取决于溶液中所有可移动离子的浓度,这使得不同溶液的测量值不具备直接可比性。为了解决这个问题,物理化学中引入了摩尔离子电导率 (Molar Ionic Conductivity) 的概念。以阳离子为例,其摩尔离子电导率 λm+ 定义为:
λm+ = κ+ / (n+c) = z+u+F
阴离子的摩尔离子电导率 λm- 的推导过程与此类似。引入摩尔电导率,本质上是为了消除浓度差异带来的影响,从而能够公平地比较不同电解质自身的导电能力。
对于整个电解质溶液,其摩尔电导率 (Molar Conductivity) Λm 是溶液中所有阳离子和阴离子的摩尔离子电导率的总和。Λm 与溶液电导率 κ 的关系为:
Λm = n+λm+ + n-λm- κ = cΛm
摩尔电导率的单位通常为 mS·m2·mol-1。
对于强电解质,其摩尔电导率与浓度的关系遵循经验性的科尔劳施定律 (Kohlrausch’s Law),即摩尔电导率随浓度的增加仅有轻微的下降:
Λm = Λm0 - K√c
而弱电解质只发生部分电离,其摩尔电导率随浓度的变化呈现非线性关系。其电离度 α 可以通过摩尔电导率来估算:
α = Λm / Λm0
在这里,Λm0 是一个关键参数,称为无限稀释摩尔电导率,代表溶质浓度趋于零时的极限值。K 是一个经验常数,主要取决于电解质类型和溶剂性质。对于任何电解质溶液,其无限稀释摩尔电导率都等于其组分离子的无限稀释摩尔离子电导率之和,这被称为科尔劳施离子独立运动定律:
Λm0 = n+λ+0 + n-λ-0
随着浓度升高,水溶液的摩尔电导率普遍下降。这主要是由离子间的相互作用引起的。每个离子周围都会形成一个符号相反的“离子氛”。两种主要效应导致了摩尔电导率的降低:
这些复杂的相互作用可以通过经典的德拜-休克尔-昂萨格 (Debey-Huckel-Onsager) 理论及其后续更复杂的模型进行定量描述。精确测量和理解这些效应对于电池、电化学传感器和腐蚀科学等领域至关重要。
准确测定溶液的电导率及其与浓度的关系,不仅需要精密的仪器,更依赖于对背后复杂物理化学过程的深刻理解。这正是专业检测实验室的核心价值所在。 精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),央企,国字头检测机构,专业的权威第三方检测机构,专业检测电解质电导率,可靠准确。欢迎沟通交流,电话19939716636
值得一提的是,质子 (H+) 和氢氧根离子 (OH-) 的离子迁移率,以及相应的极限摩尔离子电导率,远大于其他普通离子。这无法用简单的水合离子模型来解释,其背后是一种更为高效的电荷传递机制——格罗特斯机理 (Grotthuss mechanism)。质子或氢氧根离子并非作为一个独立的实体在溶液中长距离迁移,而是通过水分子形成的氢键网络,以“跳跃”的方式快速传递电荷。
最终,如果样品中只包含我们感兴趣的物种,并且该物种的电导率-浓度依赖关系已知,那么通过精确的电导率测量,便可以反推出其浓度。这在工业过程控制和环境监测等领域有着广泛应用。


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价