硅酸盐材料的宏观性能,无论是高岭石的柔顺、云母的片状解理,还是石英的坚硬,其根源都深植于原子尺度的微观构造。其核心在于硅氧四面体 [SiO₄]⁴⁻ 单元的连接方式。当这些四面体从共享一两个角顶的链状结构,进一步拓展其连接维度,便形成了更为复杂的层状与架状构造,这直接定义了材料的本质。
当每个硅氧四面体通过三个角顶的氧原子与邻居共享,便编织出了一张在二维空间内无限延伸的平面网格。可以将其想象成一个六方网,其中所有未被共享的第四个氧原子(即活性氧离子)都朝向同一侧,如图1所示。
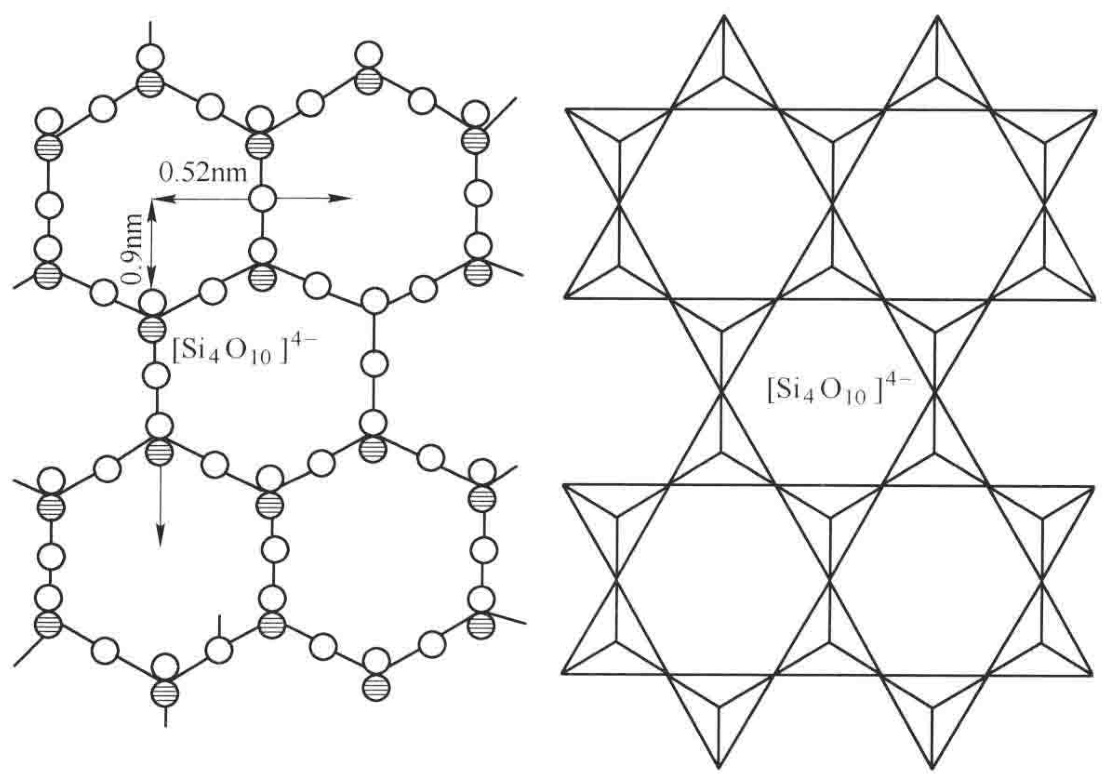
图1 连续层状的硅酸盐结构示意
这个由活性氧构成的层面,带有显著的负电性,形成了一个化学上极为活跃的界面,能够强力吸附并键合层间的金属阳离子,从而构成稳定的层状硅酸盐矿物。
这种层状硅氧骨干的基本结构单元可以表示为 [Si₂O₅]²⁻ 或 [Si₄O₁₀]⁴⁻,其硅氧原子比为1:2.5。这种结构在自然界中极为普遍,孕育了多种重要的工业矿物:
Al₂[Si₂O₅](OH)₄Mg₃[Si₄O₁₀](OH)₂Al₂[Si₄O₁₀](OH)₂Mg₃[Si₂O₅](OH)₄在这些结构中,硅氧四面体层与金属氢氧化物层(如Mg(OH)₂或Al(OH)₃层)交替堆叠。更有趣的是,硅氧四面体中的 Si⁴⁺ 常常会被 Al³⁺ 进行“类质同象”替换,如白云母 KAl₂[AlSi₃O₁₀](OH)₂。这种替换会产生额外的负电荷,需要引入K⁺等层间阳离子来平衡,这恰恰是理解云母等矿物复杂化学成分的关键。
当结构演化至极限,每个硅氧四面体的全部四个角顶都与相邻四面体共享时,一个坚固、连续的三维空间网络便形成了。这就是架状构造。
最纯粹的架状构造是二氧化硅(SiO₂),其硅氧比为1:2,整个骨架呈电中性。石英、鳞石英和方石英都是这种完美骨架的结晶体现。
然而,架状硅酸盐的真正精彩之处,同样在于铝离子的介入。当一部分 Si⁴⁺ 被配位数相同的 Al³⁺ 置换,形成 [AlO₄]⁵⁻ 四面体时,原本电中性的骨架便带上了净负电荷。这个负电荷必须由填充在骨架空隙中的阳离子来中和。这种置换机制是地球上最丰富的矿物——长石家族——的成因。
[(AlₓSiₙ₋ₓ)O₂ₙ]ˣ⁻Na⁺、K⁺、Ca²⁺、Ba²⁺。典型的例子包括钠长石 Na[AlSi₃O₈] 和钙长石 Ca[Al₂Si₂O₈]。正是这种铝硅比的变化以及填充阳离子的不同,造就了长石家族成员之间性质的细微而关键的差异。
硅氧四面体共享角顶数从0到4的演进,不仅是结构从点(孤立)、线(链状)、面(层状)到体(架状)的维度跃升,更直接映射到矿物的宏观物理性质上。
准确识别这些复杂的层状、架状乃至过渡型结构(如葡萄石 Ca₂Al[AlSi₃O₁₀](OH)₂),并理解其中的离子替换,对于原料品控、新材料开发和失效分析至关重要。这往往需要借助精密的物相与结构表征技术。
精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),专业的权威第三方检测机构,专业检测矿物物相分析央企背景,可靠准确。欢迎沟通交流,电话19939716636
下表系统总结了硅酸盐矿物的主要构造类型,为快速查阅和理解其内在关联提供了便利。
表1 硅酸盐矿物的各种构造类型
| 构造类型 | [SiO₄]⁴⁻ 共用角顶数 | 形状 | 硅氧骨干结构式 | Si:O | 实例 | |
| 孤立的 | 四面体 | 0 | 四面体 | [SiO₄]⁴⁻ | 1:4 | 锆石 Zr[SiO₄] |
| 四面体群 | 1 | 双四面体 | [Si₂O₇]⁶⁻ | 1:3.5 | 镁方柱石 Ca₂Mg[Si₂O₇] | |
| 2 | 三环 | [Si₃O₉]⁶⁻ | 1:3 | |||
| 2 | 四环 | [Si₄O₁₂]⁸⁻ | 1:3 | |||
| 2 | 六环 | [Si₆O₁₈]¹²⁻ | 1:3 | 绿柱石 Be₃Al₂[Si₆O₁₈] | ||
| 连续的 | 链状 | 2(一向) | 单链 | [SiO₃]n²⁻ | 1:3 | 透辉石 CaMg[SiO₃]₂ |
| 2, 3(一向) | 双链 | [Si₄O₁₁]n⁶⁻ | 1:2.75 | 透闪石 Ca₂Mg₅[Si₄O₁₁]₂(OH)₂ | ||
| 层状 | 3(二向) | 层 | [Si₄O₁₀]n⁴⁻ | 1:2.5 | 高岭石 Al₄[Si₄O₁₀](OH)₈ | |
| 架状 | 4(三向) | 架 | [AlₓSiₙ₋ₓO₂ₙ]ˣ⁻ | 1:2 | 石英 SiO₂、正长石 K[AlSi₃O₈] | |


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价