在离子晶体的微观世界中,原子并非随意堆砌,而是遵循着严谨的几何与能量最优化原则。一个中心阳离子被多少个阴离子所包围,并形成何种空间构型,这不仅是基础的化学问题,更直接决定了材料的宏观物理化学性质。这个核心参数,我们称之为配位数。
例如,在常见的氯化钠(NaCl)晶体中,每个Na+离子都被6个等距的Cl-离子包围,形成一个正八面体结构。因此,Na+的配位数就是6。这些围绕中心阳离子、在空间上构成特定几何形态的阴离子,其中心连线所构成的多面体,即为配位多面体。配位数为4,通常对应正四面体;配位数为6,则对应正八面体。
显而易见,配位数决定了配位多面体的基本形态。那么,这个看似简单的数字背后,究竟隐藏着哪些决定性的物理化学规则?
在理想的离子晶体中,决定一个阳离子能“容纳”多少个阴离子的首要因素,是阳离子与阴离子的半径之比(r+/r-)。这个比值本质上是一个空间几何问题:在维持体系稳定的前提下,一个大球周围最多能堆积多少个小球,并保证所有小球都能与中心大球紧密接触。
表1 离子半径比(r+/r-)与配位数及配位多面体的关联
| r+/r- | 阴离子配置形式 | 配位数 | 常见实例 |
|---|---|---|---|
| < 0.155 | 直线 | 2 | CO2 |
| 0.155 ~ 0.225 | 等边三角形 | 3 | [CO3]2- |
| 0.225 ~ 0.414 | 正四面体 | 4 | [SiO4]4- |
| 0.414 ~ 0.732 | 正八面体 | 6 | NaCl |
| 0.732 ~ 1.000 | 立方体 | 8 | CsCl |
| 1.000 | 立方八面体/密堆积 | 12 | Cu, Au (金属晶体) |
我们以配位数为6的八面体构型为例,推导其临界的离子半径比。当阳离子恰好能被6个相互接触的阴离子包围时,体系达到最紧密的稳定状态。取其中一个通过4个阴离子和1个阳离子中心的截面(如图1所示),可以建立如下几何关系:
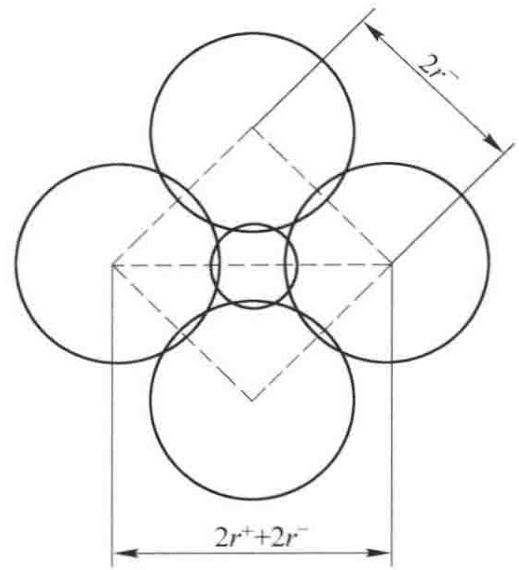 图1 计算r+/r-临界值的几何图解
图1 计算r+/r-临界值的几何图解
根据勾股定理,正方形对角线长度等于边长的√2倍。图中,正方形的边长为2r-,对角线长度为2r+ + 2r-。
(2r-)2 + (2r-)2 = (2r+ + 2r-)2
简化后得到:
√2 * (2r-) = 2r+ + 2r-
两边同除以2r-,整理可得:
r+/r- = √2 - 1 ≈ 1.414 - 1 = 0.414
这个0.414就是八面体配位(配位数为6)的临界半径比。当r+/r-小于此值时,阳离子太小,无法同时接触6个阴离子,体系不稳定,倾向于形成更低配位数的结构(如四面体);当大于此值时,阳离子则能稳定地填充在八面体空隙中。
回到最初的NaCl例子,已知Na+半径(r+)为0.098 nm,Cl-半径(r-)为0.181 nm。计算其半径比:
r+/r- = 0.098 / 0.181 = 0.54
这个值恰好落在0.414 ~ 0.732的区间内,完美地解释了为何Na+在NaCl晶体中稳定地以6配位形式存在,形成八面体构型。这正是离子半径比法则的威力所在——它为晶体结构的稳定性提供了简洁而强大的几何判据。
离子半径比法则是预测晶体结构的有力工具,在硅酸盐等复杂体系中同样适用。在硅酸盐晶体中,主要的阴离子是O2- (r- ≈ 0.132 nm)。我们可以据此预测常见阳离子的配位情况。
在实际材料开发中,准确判断Al3+究竟是以四面体还是八面体配位存在,往往直接影响材料性能。如果您在实际工作中也面临类似的物相鉴定挑战,我们非常乐意与您一同探讨解决方案。
表2 硅酸盐中主要阳离子的配位数 (rO2- = 0.132 nm)
| 阳离子 | 离子半径比 (r+/r-) | 理论预测配位数 | 实际观察到的配位数及实例 |
|---|---|---|---|
| Be2+ | 0.034 / 0.132 = 0.25 | 4 | 4: 绿柱石 |
| Si4+ | 0.039 / 0.132 = 0.30 | 4 | 4: 石英、鳞石英、方石英 |
| Al3+ | 0.057 / 0.132 = 0.43 | 4 或 6 | 4, 5, 6: 硅线石(4,6), 红柱石(5,6), 蓝晶石(4,6) |
| Mg2+ | 0.078 / 0.132 = 0.59 | 6 | 4, 6: 尖晶石(4), 镁橄榄石(6) |
| Na+ | 0.098 / 0.132 = 0.74 | 6 或 8 | 6, 8: 方沸石(6), 钠长石(8) |
| Ti4+ | 0.078 / 0.132 = 0.58 | 6 | 6: 金红石 |
| Zr4+ | 0.082 / 0.132 = 0.62 | 6 或 8 | 8: 锆石 |
| Ca2+ | 0.106 / 0.132 = 0.80 | 8 | 7, 8, 9: 钙铁榴石(7), 钙长石(8) |
| K+ | 0.133 / 0.132 ≈ 1.0 | 12 | 8 ~ 12 |
| Fe2+ | 0.082 / 0.132 = 0.62 | 6 | 绝大多数含铁硅酸盐 |
| Fe3+ | 0.067 / 0.132 = 0.51 | 6 | [FeO6]八面体,可替代Al3+ |
表3 常见阳离子与氧配位时的配位数
| 配位数 | 阳离子 |
|---|---|
| 3 | C4+, B3+, N5+ |
| 4 | Be2+, B3+, Al3+, Si4+, P5+, Ge4+, Zn2+, Cr6+, Se6+, As5+ |
| 6 | Li+, Mg2+, Al3+, Ti4+, Fe2+, Fe3+, Co2+ |
| 6 ~ 8 | Na+, Ca2+, Sr2+, Hf4+, Th4+, U4+, Lu3+ |
| 8 ~ 12 | K+, Rb+, Ba2+, Pb2+, Ce3+, Sm3+ |
离子半径比模型为我们提供了第一层近似,但现实世界的复杂性远不止于此。当理论预测与实验观察出现偏差时,我们需要引入更深层次的因素来解释。
一个晶体结构的最终形态,可以看作是一个由多个变量决定的函数:
结构 (s) = f (组分及比例 (Σn), 离子半径 (r+, r-), 极化率 (α))
一个经典的例子是NaCl和CuCl。两者的离子比例均为1:1,半径比也极其接近(NaCl为0.54,CuCl为0.53),理论上都应是6配位。但Cu+的极化能力远强于Na+,强烈的极化作用导致其配位数从理论的6降至实际的4。
温度和压力也会影响离子半径,进而改变配位数,但通常极化效应的影响更为显著。因此,要精确表征一种材料的真实结构,尤其是在存在多种可能构型或复杂取代的情况下,单纯的理论计算是不够的。这正是专业检测实验室的核心价值所在。
精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),专业的权威第三方检测机构,专业检测晶体结构分析央企背景,可靠准确。欢迎沟通交流,电话19939716636
当化学组成完全相同,仅因形成时的温度、压力等条件不同而呈现出多种晶体结构时,这种现象被称为同质多象。这是上述所有影响因素综合作用的最终体现。
最著名的例子莫过于碳(C)的两种同素异形体:金刚石和石墨。前者是等轴晶系,碳原子以sp3杂化形成坚固的四面体网络,硬度极高;后者是六方晶系,碳原子以sp2杂化形成层状结构,层间作用力弱,质地柔软。
同样,SiO2在不同温度压力下,可以形成石英、鳞石英、方石英等多种变体,每种变体都有其独特的晶体结构和物理性质。理解这些微观结构法则,不仅是材料科学的基础,更是调控材料性能、开发新材料、进行质量控制的根本依据。


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价