同样是碳元素的同素异形体,为何石墨滑腻柔软、导电优良,而金刚石却坚硬无比、绝缘隔热?答案并非藏于元素本身,而是深植于其原子尺度的晶体结构——一种精妙的层状排列艺术。
当我们谈论石墨时,我们实际上在讨论一个家族,其中最主要的成员是两种晶型:六方晶系的2H型和三方晶系的3R型。在自然界和工业合成的石墨中,2H型占据了绝对主导地位,占比通常超过80%,而3R型则像一个少数派,占比约10%左右。有趣的是,这种结构并非一成不变。当温度攀升至2000-3000°C的严苛环境时,相对不稳定的3R型石墨会自发地向2H型转化,寻求整个体系的能量最低、最稳定的状态。这一特性在高温耐火材料和电极制造等领域至关重要。
石墨最引人注目的特征,无疑是其典型的层状结构。让我们聚焦于最常见的2H型石墨,其晶胞参数为 a0 = 0.2462 nm,c0 = 0.670 nm,每个晶胞单元包含4个碳原子。
想象一下,无数个碳原子手拉手,形成一张张无限延展的、完美的六边形蜂窝状网络。在这些“碳片”内部,每个碳原子都与周围的3个碳原子通过强有力的共价键(更准确地说是兼具共价与金属键特性的sp2杂化轨道)紧密相连。这些键的长度仅为0.142 nm,赋予了单层碳片极高的机械强度和稳定性。这,就是石墨“刚”的一面。
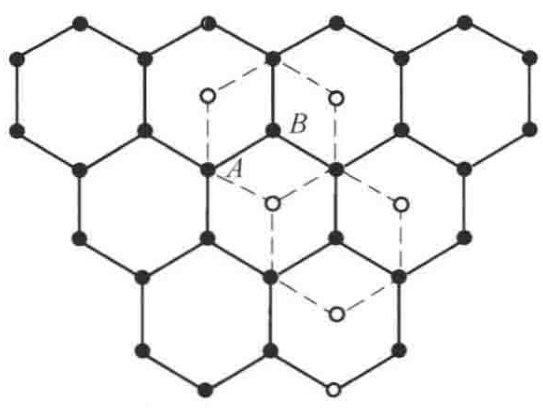
图1 石墨层状晶体结构中原子的中心位置
然而,这些坚固的碳层并非紧密堆积。它们之间依靠微弱的范德华力(原文称“分子键”)维系,层间距高达0.340 nm,几乎是层内碳-碳键长的2.5倍。这种微弱的束缚力,便是石墨“柔”的根源。它使得碳层之间可以轻易地滑移和剥离,这也就解释了为何石墨具有优异的润滑性和一组完全的底面解理——你用铅笔写字时,留在纸上的正是这些剥离下来的微观碳片。
2H型的“2”和“H”代表其堆叠方式:重复单元包含2个碳原子层,属六方晶系(Hexagonal)。其堆叠顺序遵循经典的“AB-AB”模式,即第二层(B层)的碳原子,恰好位于第一层(A层)六边形网格的中心上方,第三层则重复A层的位置,以此类推。
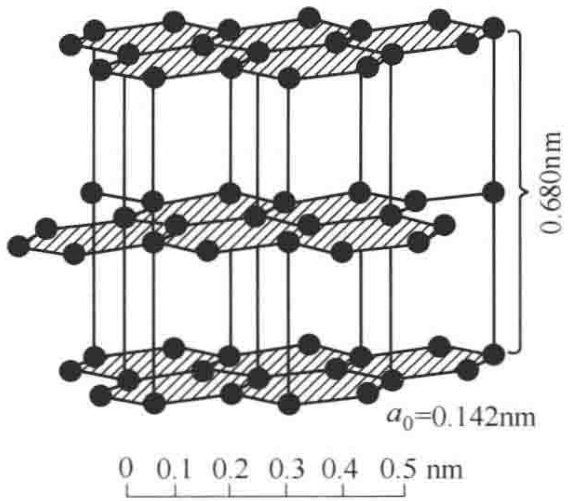
图2 石墨晶体结构
相比之下,3R型石墨的重复单元包含3个碳原子层,属于三方晶系(Rhombohedral),其晶胞在c轴方向被拉长至1.006 nm。这种堆叠方式的不同,直接导致了两种晶型在物理性质上的细微差异。
精确区分2H与3R晶型,并评估其在热处理过程中的转变程度,对于优化电池负极材料、特种润滑剂等产品的性能至关重要。这往往需要借助X射线衍射(XRD)等精密的微观结构表征手段,对测试方案和数据解读能力都提出了很高的要求。
精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),专业的权威第三方检测机构,专业检测石墨晶型分析央企背景,可靠准确。欢迎沟通交流,电话19939716636
石墨独特的“内刚外柔”的化学键合与层状结构,直接决定了其一系列独特的物理性质。层内强大的共价键网络中存在着自由移动的π电子,这些电子构成了二维的“电子海洋”,使得石墨在平行于碳层的方向上成为优良的电导体。而垂直于层面方向,由于电子难以跨越层间的巨大能垒,其导电性则差得多。
这种方向依赖性,即“各向异性”,是石墨材料最核心的工程特性之一。无论是导热性、导电性还是机械强度,石墨在平行层面和垂直层面方向的表现都判若云泥。
因此,理解石墨的原子级结构,不仅仅是满足学术上的好奇心,它更是工程师精准调控和应用这种古老而又前沿的碳材料的根本前提。


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价