镁橄榄石(Forsterite, Mg₂SiO₄)之所以在高温材料领域占据一席之地,其根本原因在于其高度稳定且坚固的晶体结构。要真正理解其性能,我们必须深入其原子尺度的构筑法则。
其结构的基础,可以看作是由氧阴离子(O²⁻)搭建起的一个近似六方最紧密堆积(hcp)的骨架。在这个致密的阴离子框架中,散布着两种尺寸和电荷截然不同的阳离子:镁离子(Mg²⁺)和硅离子(Si⁴⁺)。它们并非随意填充,而是遵循着精确的化学计量和空间排布规则。
在这个氧离子堆积的框架中,自然形成了两种可供阳离子占据的空隙:四面体空隙和八面体空隙。
因此,镁橄榄石的微观世界由两种基本结构单元构成:[SiO₄]四面体和[MgO₆]八面体。从配位数的角度看,Si⁴⁺的配位数为4,而Mg²⁺的配位数为6。
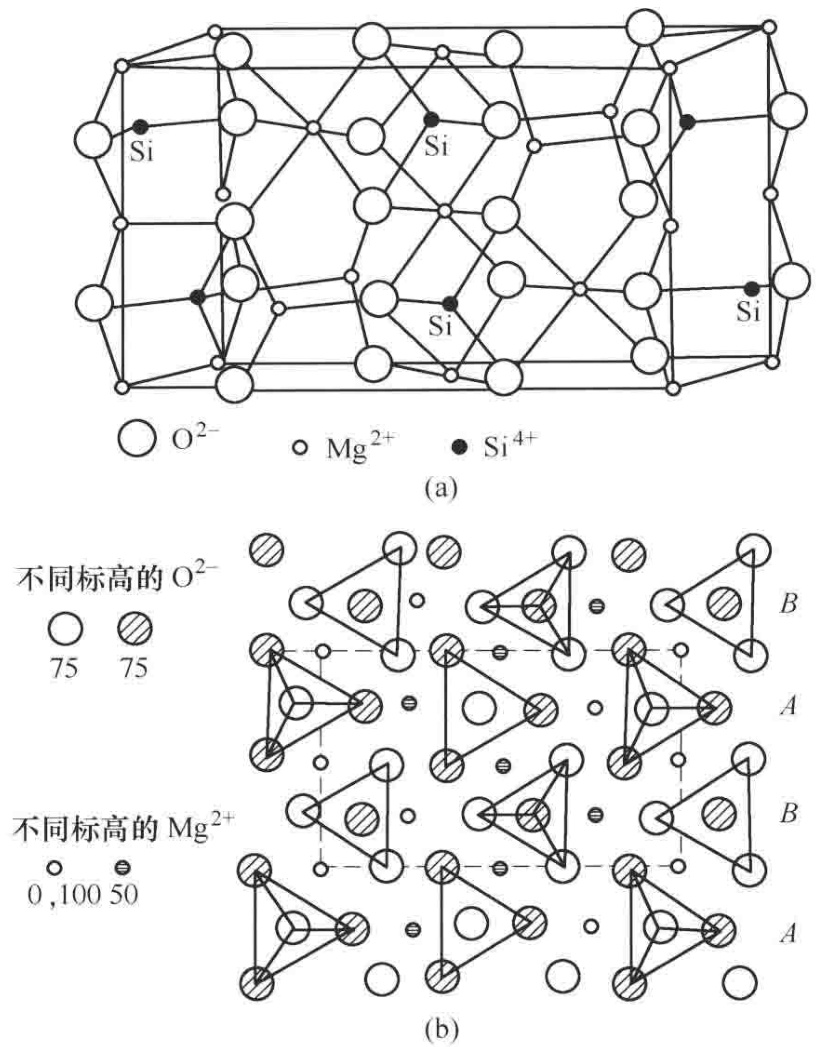 图1 镁橄榄石结构 (a)立体图;(b)平面投影
图1 镁橄榄石结构 (a)立体图;(b)平面投影
一个关键的结构特征是,[SiO₄]四面体在空间上是彼此孤立的,它们并不像石英那样通过共用氧原子形成连续的网络。这种结构在晶体化学中被称为“岛状硅酸盐”。那么,这些孤立的“硅氧岛”是如何连接成一个坚固整体的呢?答案在于[MgO₆]八面体。它们如同桥梁,将各个[SiO₄]四面体紧密地连接起来。具体来说,每个[SiO₄]四面体的一个角顶(氧离子)同时被三个[MgO₆]八面体所共用。
这种连接方式的稳定性,可以通过鲍林规则(Pauling’s rule)中的电价平衡原则来验证。对于任何一个氧离子,其接收到的来自周围阳离子的静电键强总和,必须与其自身的电价(-2)相抵消。计算如下:
来自1个Si⁴⁺的键强贡献(配位数为4) + 来自3个Mg²⁺的键强贡献(配位数为6) = (4/4) + 3 × (2/6) = 1 + 1 = 2
计算结果完美地平衡了氧离子的电价,这从根本上解释了镁橄榄石结构为何具有强大的结合力和内在的牢固性。准确表征这种复杂的晶体结构,对于材料的性能评估与质量控制至关重要。
精工博研测试技术(河南)有限公司(原郑州三磨所国家磨料磨具质量检验检测中心),专业的权威第三方检测机构,专业检测晶体物相分析央企背景,可靠准确。欢迎沟通交流,电话19939716636
镁橄榄石并非孤例,它与铁橄榄石(Fayalite, Fe₂SiO₄)、锰橄榄石(Tephroite, Mn₂SiO₄)等构成了一个同构的橄榄石族。当二价阳离子从Mg²⁺被Fe²⁺或Mn²⁺替换时,由于离子半径的差异,会导致晶胞参数发生规律性的变化,如下表所示。
表1 镁橄榄石、铁橄榄石及锰橄榄石的晶胞参数
| 晶胞参数 | 镁橄榄石 | 铁橄榄石 | 锰橄榄石 |
| a₀/nm | 0.4756 | 0.4817 | 0.486~0.490 |
| b₀/nm | 1.0195 | 1.0477 | 1.060~1.062 |
| c₀/nm | 0.5981 | 0.6105 | 0.622~0.625 |
从数据中可以清晰地看到,随着阳离子半径的增大(Mg²⁺ < Fe²⁺ < Mn²⁺),晶胞的三个轴长(a₀, b₀, c₀)均呈现出系统性的增长。这种结构上的细微差异,直接影响着材料的密度、熔点、热膨胀系数等一系列宏观物理化学性质。


 首页
首页
 检测领域
检测领域
 服务项目
服务项目
 咨询报价
咨询报价